Phân Biệt Dương Tính Thật/ Giả trong real-time PCR (qpcr) – XÉT NGHIỆM THÚ Y
Xét nghiệm Real-time PCR (qPCR) là một công cụ chẩn đoán “vàng” trong thú y nhờ độ nhạy và độ đặc hiệu vượt trội, đặc biệt hữu ích cho các bệnh truyền nhiễm. Tuy nhiên, một thách thức lớn trong thực tế là việc phân biệt giữa dương tính thật (mẫu thực sự chứa mầm bệnh) và dương tính giả (tín hiệu dương tính không phản ánh sự hiện diện của mầm bệnh). Việc nhận diện và xử lý chính xác các trường hợp dương tính giả là cực kỳ quan trọng để tránh đưa ra các quyết định sai lầm trong chẩn đoán và kiểm soát dịch bệnh, đặc biệt với các bệnh nguy hiểm như Dịch tả lợn Châu Phi (ASFV), Lở mồm long móng (FMDV) hay Hội chứng rối loạn sinh sản và hô hấp ở lợn (PRRSV).
1. Tổng Quan Về Dương Tính Giả và Dương Tính Thật trong qPCR
| Khái niệm | Mô tả |
|---|---|
| Dương tính thật | Mẫu thực sự chứa vật liệu di truyền của tác nhân gây bệnh, phản ánh chính xác tình trạng nhiễm bệnh. |
| Dương tính giả | Tín hiệu dương tính trong PCR không xuất phát từ mầm bệnh đích, thường do lỗi kỹ thuật, nhiễm chéo hoặc primer/probe không đặc hiệu. |
2. Các Nguyên Nhân Chính Gây Dương Tính Giả trong Real-time PCR
Dương tính giả có thể phát sinh từ nhiều nguồn khác nhau trong quá trình thực hiện xét nghiệm:
- Nhiễm chéo trong quá trình thao tác: Đây là nguyên nhân phổ biến nhất, thường do:
– Aerosol hoặc giọt bắn: Từ các mẫu dương tính mạnh (có Ct thấp) bắn sang các mẫu âm tính hoặc giếng đối chứng.Thiếu quy trình vô trùng nghiêm ngặt: Không thay găng tay thường xuyên, không sử dụng pipet riêng biệt cho từng khu vực, hoặc dụng cụ (pipet, tip, ống reaction) không được khử trùng sạch sẽ hoặc tái sử dụng không đúng cách.
– Thiết kế primer/probe không đặc hiệu: Primer/probe được thiết kế kém có thể bắt chéo với DNA/RNA của các vi sinh vật không phải mục tiêu hoặc DNA chủ, dẫn đến khuếch đại không đặc hiệu. Nguy cơ này tăng lên khi nồng độ template đích thấp.
- Ô nhiễm hóa chất:
– Master mix hoặc nước PCR: Các hóa chất không đạt chuẩn hoặc bị ô nhiễm trong quá trình sản xuất, vận chuyển có thể chứa DNA/RNA ngoại lai. Do đó, việc sử dụng nước PCR loại nuclease-free và kiểm tra chất lượng master mix là vô cùng quan trọng.
– DNA/RNA tạp nhiễm: Có thể tồn tại trong các hóa chất sử dụng hàng ngày hoặc trên các bề mặt làm việc.
- Tín hiệu nền cao, ngưỡng Ct không rõ ràng: Một số tín hiệu giả có thể xuất hiện ở các chu kỳ muộn (thường là Ct > 37–40), đây có thể là nhiễu nền hoặc khuếch đại không đặc hiệu ở mức độ rất thấp.
3. Phân Biệt Dương Tính Giả và Dương Tính Thật: Tiêu Chí Kỹ Thuật Chuyên Sâu
Việc phân biệt không chỉ dựa vào giá trị Ct mà còn yêu cầu phân tích toàn diện biểu đồ khuếch đại và các đặc điểm kỹ thuật khác:
3.1. Đặc Điểm Cơ Bản Của Đường Cong Khuếch Đại (Amplification Curve)
Một biểu đồ khuếch đại điển hình bao gồm 3 pha chính:
– Pha nền (Baseline): Các chu kỳ đầu, tín hiệu huỳnh quang nằm trong giới hạn nhiễu nền của thiết bị. Đây là pha không có sự khuếch đại đáng kể.
– Pha lũy tiến (Exponential phase): Tín hiệu huỳnh quang tăng theo hàm mũ một cách ổn định, phản ánh sự nhân bản đặc hiệu của sản phẩm PCR. Tốc độ tăng tín hiệu trong pha này là quan trọng nhất để đánh giá hiệu suất phản ứng.
– Pha bão hoà: Khuếch đại đạt bão hòa do một trong các thành phần phản ứng (primer, enzyme, dNTPs) cạn kiệt hoặc do sự ức chế phản ứng. Tốc độ tăng tín hiệu chậm lại hoặc dừng hẳn.
– Giá trị Ct (Cycle threshold) được xác định tại điểm giao giữa đường cong khuếch đại và ngưỡng phát hiện (threshold line), thường được đặt trên mức nền nhiễu cố định. Ct càng thấp, nồng độ vật liệu di truyền ban đầu càng cao.
3.2. Các Dấu Hiệu Phân Biệt Dương Tính Thật và Dương Tính Giả Trên Biểu Đồ Real-time PCR
| Đặc điểm kỹ thuật | Dương tính thật | Dương tính giả |
|---|---|---|
| Hình dạng đường cong | S-curve rõ ràng, tăng đều, mượt mà và có pha lũy tiến ổn định. | Không có dạng S điển hình hoặc tăng đột ngột, tuyến tính, không mượt mà. |
| Giá trị Ct | Thấp, ổn định (thường ≤ 35), xuất hiện sớm trong các chu kỳ đầu. | Cao bất thường (> 37–40), sát giới hạn phát hiện của máy, hoặc xuất hiện rất muộn. |
| Độ lặp lại giữa các replicates | Đồng nhất giữa các giếng lặp lại về hình dạng và giá trị Ct. | Dao động lớn hoặc chỉ xuất hiện ở 1 giếng đơn lẻ không có sự lặp lại. |
| Tín hiệu nền (baseline) | Thấp, ổn định, ít dao động. | Nền nhiễu cao, dao động ngẫu nhiên, khó xác định ngưỡng rõ ràng. |
| Pha lũy tiến | Có tốc độ tăng mạnh, đều đặn và dốc. | Không tăng rõ ràng hoặc dốc thấp, không có pha lũy tiến thực sự. |
| Tăng tín hiệu sau ngưỡng 38–40 | Cần xác nhận lại, có thể nghi ngờ nồng độ template rất thấp hoặc nhiễu. | Khả năng cao là nhiễu nền hoặc khuếch đại không đặc hiệu (non-specific amplification). |
| Kiểm tra Melt Curve (nếu áp dụng) | Một đỉnh đặc hiệu rõ ràng ở nhiệt độ tan chảy (Tm) của sản phẩm đích. | Nhiều đỉnh hoặc đỉnh không đúng nhiệt độ tan của sản phẩm đích, hoặc không có đỉnh rõ ràng. |
3.3. Ví Dụ Minh Họa: So Sánh Biểu Đồ Thực Tế
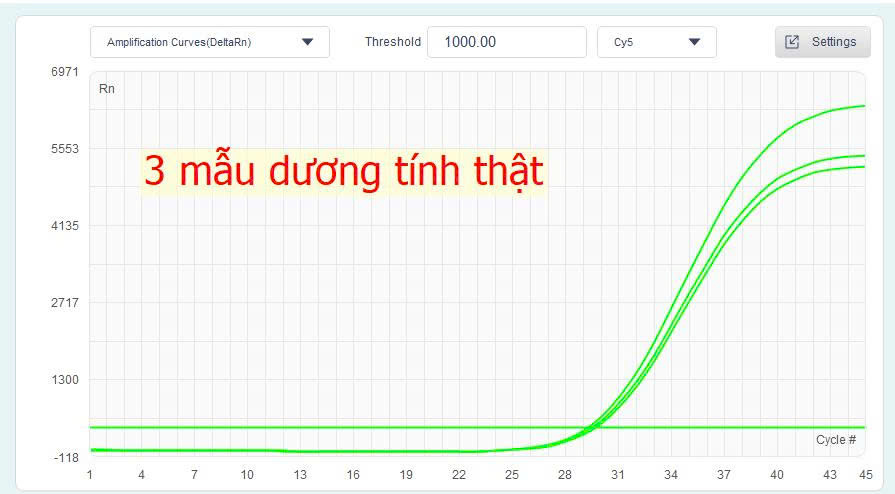
- Dương tính thật:

– Ct điển hình: Ct = 29.5 (HÌNH).
– Đường cong hiển thị S-curve rõ ràng, mượt mà, tăng đều, và xuất hiện sớm trong khoảng 20–30 chu kỳ.
– Các giếng replicates có đường cong và Ct nhất quán.
- Dương tính giả do nhiễu nền hoặc khuếch đại không đặc hiệu:
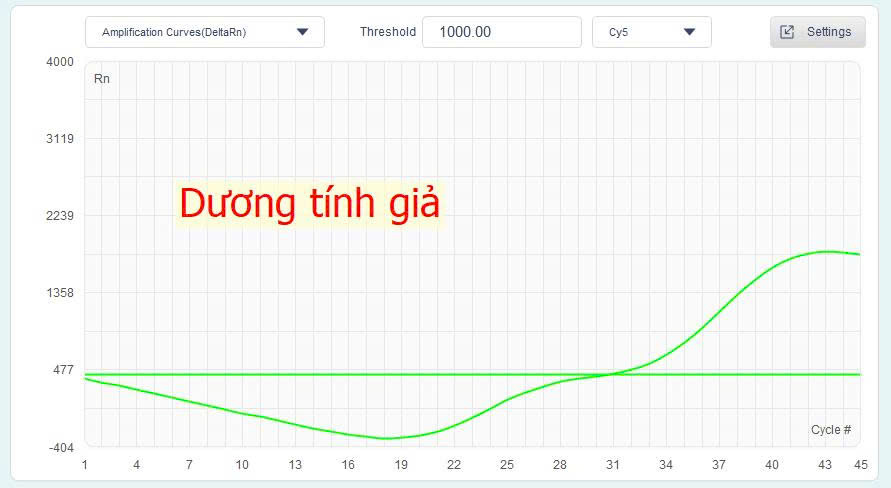 – Ct điển hình: Ct = 30.5 (ví dụ).
– Ct điển hình: Ct = 30.5 (ví dụ).
– Đường cong bắt đầu tăng sau chu kỳ 31, không có dạng S-curve rõ ràng, thường dao động hoặc tăng rất chậm.
– Không lặp lại ở các giếng khác hoặc chỉ xuất hiện ở một giếng đơn lẻ, điều này rất đáng ngờ.
4. Các Lưu Ý Quan Trọng Khi Thực Hiện Xét Nghiệm PCR Trong Thú Y
Để giảm thiểu dương tính giả và nâng cao độ tin cậy của kết quả, cần tuân thủ nghiêm ngặt các quy trình và lưu ý sau:
4.1. Thiết Kế Không Gian Phòng Thí Nghiệm (Thiết Kế Luồng Một Chiều)
– Phân tách rõ ràng 3 khu vực chức năng:
– Khu vực chuẩn bị Master Mix: Nơi pha trộn các hóa chất không có DNA/RNA template (nước PCR, enzyme, dNTPs, primer, probe).
– Khu vực thêm Template: Nơi thêm mẫu chiết tách DNA/RNA vào ống reaction đã có master mix.
– Khu vực Khuếch đại và Phân tích: Nơi đặt máy Real-time PCR và thực hiện phân tích dữ liệu.
– Hạn chế tối đa việc di chuyển ngược chiều: Luôn di chuyển từ khu vực sạch (chuẩn bị master mix) sang khu vực bẩn hơn (thêm template) và cuối cùng là khu vực khuếch đại. Đây là nguyên tắc cốt lõi để tránh lây nhiễm chéo.
4.2. Kiểm Soát Chất Lượng Mẫu Nghiêm Ngặt
– Lấy mẫu đúng vị trí: Lấy mẫu tại vị trí nghi ngờ nhiễm bệnh (máu, dịch mũi, phân, mô bệnh… tùy thuộc vào từng loại bệnh) để đảm bảo thu thập đủ vật liệu di truyền của mầm bệnh.
– Bảo quản mẫu đúng cách: Ngay lập tức bảo quản lạnh mẫu sau khi lấy (hoặc đông lạnh sâu ở -20°C đến -80°C đối với RNA) để tránh thoái hóa DNA/RNA, đặc biệt quan trọng với các mẫu có tải lượng mầm bệnh thấp.
– Chiết tách hiệu quả: Đảm bảo quy trình chiết tách DNA/RNA đạt hiệu quả cao, loại bỏ các chất ức chế PCR có trong mẫu.
4.3. Sử Dụng Các Control Phù Hợp và Đầy Đủ
– Negative Control (NTC – No Template Control): Sử dụng nước không chứa nuclease (nuclease-free water) thay cho template. NTC dương tính cho thấy sự ô nhiễm hóa chất hoặc nhiễm chéo trong quá trình chuẩn bị phản ứng.
– Positive Control: Sử dụng một mẫu chuẩn đã biết là dương tính với mầm bệnh đích. Control này giúp kiểm tra độ nhạy của hệ thống, hiệu quả của phản ứng khuếch đại và các hóa chất PCR. Nếu Positive Control âm tính, phản ứng của bạn có vấn đề.
– Internal Control (IC): Là một hệ thống khuếch đại độc lập được thêm vào mỗi giếng phản ứng, bao gồm cả mẫu thử và control. IC giúp kiểm tra hiệu quả của quá trình chiết tách acid nucleic từ mẫu và phát hiện các chất ức chế PCR có trong mẫu. IC dương tính cho thấy quá trình chiết tách và phản ứng PCR diễn ra bình thường, kể cả khi mẫu thử âm tính với mầm bệnh.
4.4. Đào Tạo Kỹ Thuật Viên Chuyên Sâu
– Kỹ năng thao tác chính xác và vô trùng: Kỹ thuật viên phải được đào tạo bài bản về kỹ năng pipet chính xác, tránh tạo aerosol, và tuân thủ nghiêm ngặt các quy tắc vô trùng trong phòng thí nghiệm.
– Khả năng đọc và phân tích dữ liệu PCR: Kỹ thuật viên cần có khả năng đọc hiểu biểu đồ khuếch đại, nhận diện các dạng đường cong bất thường, đánh giá tín hiệu nền, và đối chiếu với các control một cách có cơ sở, tránh phụ thuộc hoàn toàn vào phần mềm tự động.
5. Kết Luận
Trong thực hành chẩn đoán thú y, Real-time PCR là một phương pháp đáng tin cậy. Tuy nhiên, việc phân tích biểu đồ khuếch đại một cách chuyên sâu là chìa khóa để tránh sai lệch trong diễn giải kết quả. Khả năng phân biệt dương tính thật – dương tính giả không chỉ dựa vào giá trị Ct mà còn phụ thuộc vào kinh nghiệm phân tích hình dạng đường cong, độ lặp lại giữa các replicates, tín hiệu nền, và tính logic sinh học của kết quả. Đặc biệt, với các bệnh nguy hiểm như ASFV, FMDV, PRRSV, việc xác định sai dương tính có thể gây hậu quả lớn về kinh tế và công tác kiểm soát dịch bệnh. Do đó, việc xây dựng và tuân thủ một hệ thống quản lý chất lượng nghiêm ngặt, từ khâu lấy mẫu, bảo quản, chiết tách, chuẩn bị phản ứng đến phân tích dữ liệu, là yếu tố then chốt để đảm bảo độ tin cậy tối đa cho xét nghiệm Real-time PCR trong chẩn đoán bệnh truyền nhiễm động vật.
*** BÀI VIẾT NÀY LÀ ĐÚC KẾT TỪ KINH NGHIỆM THỰC TIỄN NHIỀU NĂM NGHIÊN CỨU VÀ THỰC NGHIỆM TỪ ĐỘI NGŨ NHÂN SỰ CÔNG TY TNHH CNSH CAO GIA NHẰM CHIA SẺ THÊM MỘT SỐ GÓC NHÌN CHO CÁC KỸ THUẬT VIÊN PHÒNG XÉT NGHIỆM – NHỮNG ANH/CHỊ LÀM VIỆC LIÊN QUAN – Tuy nhiên, mọi nội dung chỉ nên áp dụng khi đã hiểu rõ bản chất và cần tuyệt đối thận trọng trong thao tác thực tế.
Đội ngũ kỹ thuật CNSH Cao Gia
CÔNG NGHỆ SINH HỌC CAO GIA
Trách nhiệm – Khoa học – Khát vọng


